Giáo án Hóa học Lớp 8 - Tuần 31 - Năm học 2018-2019 - Trường THCS Ngô Quang Nhã
I. MỤC TIÊU
- Củng cố lại các kiến thức ở chương 5
- Vậng dụng thành thạo các dạng bài tập:
+ Nhận biết.
+ Tính theo phương trình hóa học.
+ Lập phương trình hóa học.
II. CHUẨN BỊ
1. Giáo viên : Đề kiểm tra 1 tiết
2. Học sinh: Ôn tập kiến thức ở chương 5.
III. TỔ CHỨC CÁC HOẠT ĐỘNG DẠY HỌC
1. Ổn định lớp: Kiểm tra sĩ số
8A: ................; 8B: ..................
2. Kiểm tra bài cũ: (Không)
3. Nội dung kiểm tra:
- MA TRẬN
(BẢNG HAI CHIỀU)
Bạn đang xem tài liệu "Giáo án Hóa học Lớp 8 - Tuần 31 - Năm học 2018-2019 - Trường THCS Ngô Quang Nhã", để tải tài liệu gốc về máy hãy click vào nút Download ở trên.
Tóm tắt nội dung tài liệu: Giáo án Hóa học Lớp 8 - Tuần 31 - Năm học 2018-2019 - Trường THCS Ngô Quang Nhã
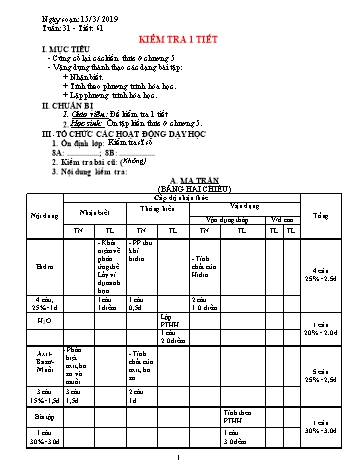
Ngày soạn: 15/ 3/ 2019 Tuần: 31 - Tiết: 61 KIỂM TRA 1 TIẾT I. MỤC TIÊU - Củng cố lại các kiến thức ở chương 5 - Vậng dụng thành thạo các dạng bài tập: + Nhận biết. + Tính theo phương trình hóa học. + Lập phương trình hóa học. II. CHUẨN BỊ 1. Giáo viên : Đề kiểm tra 1 tiết 2. Học sinh: Ôn tập kiến thức ở chương 5. III. TỔ CHỨC CÁC HOẠT ĐỘNG DẠY HỌC 1. Ổn định lớp: Kiểm tra sĩ số 8A: ................; 8B: .................. 2. Kiểm tra bài cũ: (Không) 3. Nội dung kiểm tra: MA TRẬN (BẢNG HAI CHIỀU) Nội dung Cấp độ nhận thức Tổng Nhận biết Thông hiểu Vận dụng Vận dụng thấp V/d cao TN TL TN TL TN TL TL TL Hiđro - Khái niệm về phản ứng thế. Lấy ví dụ minh họa - PP thu khí hiđro - Tính chất của Hiđro 4 câu 25%=2.5đ 4 câu, 25%= 1đ 1câu 1điểm 1 câu 0,5đ 2 câu 1.0.điểm H2O Lập PTHH 1 câu 20%= 2.0đ 1 câu 2.0 điểm Axit-Bazơ-Muối - Phân biệt axit,ba zơ và muối - Tính chất của axit, ba zơ 5 câu 25%=2,5đ 3 câu 15%=1,5đ 3 câu 1,5đ 2 câu 1đ Bài tập Tính theo PTHH 1 câu 30%=3.0đ 1 câu 30%=3.0đ 1 câu 3.0 đểm Tổng số câu Tổng số điểm Tỉ lệ % 4 câu 2,5đ 25% 4 câu 3,5đ 35% 3 câu 4.0đ 40% 11 câu 10 đ B. Đề: Đề 1: I. PHẦN TRẮC NGHIỆM: (4 điểm) Hãy khoanh tròn vào chữ cái đầu câu trả lời đúng nhất. (Từ câu 1 đến câu 8 đúng mỗi câu được 0,5 điểm) Câu 1: Ở nhiệt độ cao khí hiđro tác dụng được với dãy chất nào sau đây? A. O2, CuO. B. H2O, O2. C. NaOH, CuO. D. CuO, FeCl2. Câu 2: Trong phòng thí nghiệm người ta điều chế khí hiđrô bằng cách nào? A. Điện phân nước. B. Dùng than khử oxi của nước trong lò khí than. C. Điều chế hiđrô từ khí tự nhiên. D. Cho axit (HCl hoặc H2SO4 loãng) tác dụng với kim loại kẽm (hoặc sắt, nhôm). Câu 3: Khi thu khí H2 vào ống nghiệm bằng cách đẩy không khí ta phải để úp ngược ống nghiệm vì: A. Khí H2 tan ít trong nước. B. Khí H2 nặng hơn không khí. C. Khí H2 có nhiệt độ hóa lỏng thấp. D. Khí H2 nhẹ hơn không khí. Câu 4: Dung dịch axit làm quỳ tím chuyển sang màu gì? A. Xanh. B. Đỏ. C. Tím. D. Vàng. Câu 5: Dung dịch bazơ làm quỳ tím chuyển sang màu gì? A. Xanh. B. Đỏ. C. Tím. D. Vàng. Câu 6: Dãy chất nào sau đây đều là axit? A. NaOH, CaO, H3PO4 B. Na2SO4, Na2O, H3PO4 C. HCl, H2SO4, H3PO4 D. NaCl, HCl, Fe2O3. Câu 7: Dãy chất nào sau đây đều là bazơ? A. HCl, Na2SO4, Fe(OH)3 B. NaOH, Ca(OH)2, Fe(OH)3 C. Na2SO4, NaCl, Fe(OH)3 D. NaCl, NaOH, Fe(OH)3 Câu 8: Dãy chất nào sau đây đều là muối? A. HCl, F2O3, CaCO3 B. NaOH, H2SO4, CaO C. Na2SO4, NaCl, CaCO3 D. NaCl, HCl, CaO II. PHẦN TỰ LUẬN: (6 điểm) Câu 9: (1điểm) Phản ứng thế là gì? Cho ví dụ. Câu 10: (2 điểm) Lập các phương trình hóa học sau đây : a) H2 + O2 b) P2O5 + H2O → c) Na2O + H2O → d) CuO + H2 Câu 11: (3 điểm) Cho 6,5 gam kẽm tác dụng với dung dịch axit clohđric tạo thành muối kẽm clorua (ZnCl2) và khí hiđrô. Hãy tính: a) Khối lượng axit clohiđric cần dùng. b) Thể tích khí hiđrô (ở đktc) thu được. Học sinh được sử dụng bảng tuần hoàn các nguyên tố hóa học. Đề 2: Hãy khoanh tròn vào chữ cái đầu câu trả lời đúng nhất. (Từ câu 1 đến câu 8 đúng mỗi câu được 0,5 điểm) Câu 1: Khi thu khí H2 vào ống nghiệm bằng cách đẩy không khí ta phải để úp ngược ống nghiệm vì: A. Khí H2 tan ít trong nước. B. Khí H2 nặng hơn không khí. C. Khí H2 có nhiệt độ hóa lỏng thấp. D. Khí H2 nhẹ hơn không khí. Câu 2: Dung dịch axit làm quỳ tím chuyển sang màu gì? A. Xanh. B. Đỏ. C. Tím. D. Vàng. Câu 3: Dung dịch bazơ làm quỳ tím chuyển sang màu gì? A. Xanh. B. Đỏ. C. Tím. D. Vàng. Câu 4: Dãy chất nào sau đây đều là axit? A. NaOH, CaO, H3PO4 B. Na2SO4, Na2O, H3PO4 C. HCl, H2SO4, H3PO4 D. NaCl, HCl, Fe2O3. Câu 5: Dãy chất nào sau đây đều là bazơ? A. HCl, Na2SO4, Fe(OH)3 B. NaOH, Ca(OH)2, Fe(OH)3 C. Na2SO4, NaCl, Fe(OH)3 D. NaCl, NaOH, Fe(OH)3 Câu 6: Dãy chất nào sau đây đều là muối? A. HCl, F2O3, CaCO3 B. NaOH, H2SO4, CaO C. Na2SO4, NaCl, CaCO3 D. NaCl, HCl, CaO Câu 7: Ở nhiệt độ cao khí hiđro tác dụng được với dãy chất nào sau đây? A. O2, CuO. B. H2O, O2. C. NaOH, CuO. D. CuO, FeCl2. Câu 8: Trong phòng thí nghiệm người ta điều chế khí hiđrô bằng cách nào? A. Điện phân nước. B. Dùng than khử oxi của nước trong lò khí than. C. Điều chế hiđrô từ khí tự nhiên. D. Cho axit (HCl hoặc H2SO4 loãng) tác dụng với kim loại kẽm (hoặc sắt, nhôm). II. PHẦN TỰ LUẬN: (6 điểm) Câu 9: (1điểm) Phản ứng thế là gì? Cho ví dụ. Câu 10: (2 điểm) Lập các phương trình hóa học sau đây : a) H2 + O2 b) P2O5 + H2O → c) Na2O + H2O → d) CuO + H2 Câu 11: (3 điểm) Cho 6,5 gam kẽm tác dụng với dung dịch axit clohđric tạo thành muối kẽm clorua (ZnCl2) và khí hiđrô. Hãy tính: a) Khối lượng axit clohiđric cần dùng. b) Thể tích khí hiđrô (ở đktc) thu được. Học sinh được sử dụng bảng tuần hoàn các nguyên tố hóa học. ĐỀ 3: I. PHẦN TRẮC NGHIỆM: (4 điểm) Hãy khoanh tròn vào chữ cái đầu câu trả lời đúng nhất. (Từ câu 1 đến câu 8 đúng mỗi câu được 0,5 điểm) Câu 1: Khi thu khí H2 vào ống nghiệm bằng cách đẩy không khí ta phải để úp ngược ống nghiệm vì: A. Khí H2 tan ít trong nước. B. Khí H2 nặng hơn không khí. C. Khí H2 có nhiệt độ hóa lỏng thấp. D. Khí H2 nhẹ hơn không khí. Câu 2: Ở nhiệt độ cao khí hiđro tác dụng được với dãy chất nào sau đây? A. O2, CuO. B. H2O, O2. C. NaOH, CuO. D. CuO, FeCl2. Câu 3: Trong phòng thí nghiệm người ta điều chế khí hiđrô bằng cách nào? A. Điện phân nước. B. Dùng than khử oxi của nước trong lò khí than. C. Điều chế hiđrô từ khí tự nhiên. D. Cho axit (HCl hoặc H2SO4 loãng) tác dụng với kim loại kẽm (hoặc sắt, nhôm). Câu 4: Dung dịch axit làm quỳ tím chuyển sang màu gì? A. Xanh. B. Đỏ. C. Tím. D. Vàng. Câu 5: Dung dịch bazơ làm quỳ tím chuyển sang màu gì? A. Xanh. B. Đỏ. C. Tím. D. Vàng. Câu 6: Dãy chất nào sau đây đều là muối? A. HCl, F2O3, CaCO3 B. NaOH, H2SO4, CaO C. Na2SO4, NaCl, CaCO3 D. NaCl, HCl, CaO Câu 7: Dãy chất nào sau đây đều là axit? A. NaOH, CaO, H3PO4 B. Na2SO4, Na2O, H3PO4 C. HCl, H2SO4, H3PO4 D. NaCl, HCl, Fe2O3. Câu 8: Dãy chất nào sau đây đều là bazơ? A. HCl, Na2SO4, Fe(OH)3 B. NaOH, Ca(OH)2, Fe(OH)3 C. Na2SO4, NaCl, Fe(OH)3 D. NaCl, NaOH, Fe(OH)3 II. PHẦN TỰ LUẬN: (6 điểm) Câu 9: (1điểm) Phản ứng thế là gì? Cho ví dụ. Câu 10: (2 điểm) Lập các phương trình hóa học sau đây : a) H2 + O2 b) P2O5 + H2O → c) Na2O + H2O → d) CuO + H2 Câu 11: (3 điểm) Cho 6,5 gam kẽm tác dụng với dung dịch axit clohđric tạo thành muối kẽm clorua (ZnCl2) và khí hiđrô. Hãy tính: a) Khối lượng axit clohiđric cần dùng. b) Thể tích khí hiđrô (ở đktc) thu được. Học sinh được sử dụng bảng tuần hoàn các nguyên tố hóa học. ĐỀ 4: I. PHẦN TRẮC NGHIỆM: (4 điểm) Hãy khoanh tròn vào chữ cái đầu câu trả lời đúng nhất. (Từ câu 1 đến câu 8 đúng mỗi câu được 0,5 điểm) Câu 1: Dung dịch bazơ làm quỳ tím chuyển sang màu gì? A. Xanh. B. Đỏ. C. Tím. D. Vàng. Câu 2: Dãy chất nào sau đây đều là axit? A. NaOH, CaO, H3PO4 B. Na2SO4, Na2O, H3PO4 C. HCl, H2SO4, H3PO4 D. NaCl, HCl, Fe2O3. Câu 3: Dãy chất nào sau đây đều là bazơ? A. HCl, Na2SO4, Fe(OH)3 B. NaOH, Ca(OH)2, Fe(OH)3 C. Na2SO4, NaCl, Fe(OH)3 D. NaCl, NaOH, Fe(OH)3 Câu 4: Dãy chất nào sau đây đều là muối? A. HCl, F2O3, CaCO3 B. NaOH, H2SO4, CaO C. Na2SO4, NaCl, CaCO3 D. NaCl, HCl, CaO Câu 5: Ở nhiệt độ cao khí hiđro tác dụng được với dãy chất nào sau đây? A. O2, CuO. B. H2O, O2. C. NaOH, CuO. D. CuO, FeCl2. Câu 6: Trong phòng thí nghiệm người ta điều chế khí hiđrô bằng cách nào? A. Điện phân nước. B. Dùng than khử oxi của nước trong lò khí than. C. Điều chế hiđrô từ khí tự nhiên. D. Cho axit (HCl hoặc H2SO4 loãng) tác dụng với kim loại kẽm (hoặc sắt, nhôm). Câu 7: Khi thu khí H2 vào ống nghiệm bằng cách đẩy không khí ta phải để úp ngược ống nghiệm vì: A. Khí H2 tan ít trong nước. B. Khí H2 nặng hơn không khí. C. Khí H2 có nhiệt độ hóa lỏng thấp. D. Khí H2 nhẹ hơn không khí. Câu 8: Dung dịch axit làm quỳ tím chuyển sang màu gì? A. Xanh. B. Đỏ. C. Tím. D. Vàng. II. PHẦN TỰ LUẬN: (6 điểm) Câu 9: (1điểm) Phản ứng thế là gì? Cho ví dụ. Câu 10: (2 điểm) Lập các phương trình hóa học sau đây : a) H2 + O2 b) P2O5 + H2O → c) Na2O + H2O → d) CuO + H2 Câu 11: (3 điểm) Cho 6,5 gam kẽm tác dụng với dung dịch axit clohđric tạo thành muối kẽm clorua (ZnCl2) và khí hiđrô. Hãy tính: a) Khối lượng axit clohiđric cần dùng. b) Thể tích khí hiđrô (ở đktc) thu được. Học sinh được sử dụng bảng tuần hoàn các nguyên tố hóa học. c. Đáp án – thang điểm I. PHẦN TRẮC NGHIỆM: (4 điểm) Chọn đúng mỗi câu được 0,5 điểm. Câu 1 2 3 4 5 6 7 8 Đề 1 A D D B A C B C Đề 2 D B A C B C A D Đề 3 D A D B A C C B Đề 4 A C B C A D D B II. PHẦN TỰ LUẬN: (6 điểm) Câu 9: - Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất trong đó nguyên tử của đơn chất đã thay thế nguyên tử của 1 nguyên tố trong hợp chất. (0.5đ) - VD: Zn + 2HCl ZnCl2 + H2 Câu 10: (2 điểm) - Viết đúng mỗi PT được 0.5đ - Viết sai CTHH thì PT đó không có điểm, cân bằng sai trừ ½ số điểm của PT đó. a) 2H2 + O2 2H2O b) P2O5 + 3H2O → 2H2PO4 c) Na2O + H2O → 2NaOH d) CuO + H2 Cu + H2O Câu 11: (3 điểm) nCuO = 6,5 : 65 = 0,1 (mol) (0,5đ) Zn + 2HCl ZnCl2 + H2 (0,5đ) 1 mol 1mol 1 mol 0,1 mol 0,2 mol 0,1 mol (1,0đ) a. Thể tích khí H2 (ở đktc); VH2 = 0,1 x 22,4 = 2,24 (l) (0,5đ) b. Khối lượng đồng thu được: mHCl = 0,2 x 36,5 = 7,2 (g) (0,5đ) 4. Củng cố: 5. Hướng dẫn học sinh tự học, làm bài tập và soạn bài mới ở nhà: Thống kê điểm Lớp / sĩ số Thang điểm So sánh lần kiểm tra trước ( từ 5 trở lên) [0 ;5 ) [5 ; 7) [7 ; 9) [9 ; 10) Tăng % Giảm % 8A: 8B: Tổng cộng: IV. RÚT KINH NGHIỆM GV: HS:. soạn: 15/3/2019 Tuần: 31-Tiết: 62 Chương 6: DUNG DỊCH Bài 40: DUNG DỊCH I. MỤC TIÊU 1. Kiến thức, kỹ năng, thái độ: - Kiến thức: Biết được: - Khái niệm về dung môi, chất tan, dung dịch, dung dịch bão hoà, dung dịch chưa bão hoà. - Biện pháp làm quá trình hoà tan một số chất rắn trong nước xảy ra nhanh hơn. - Kĩ năng: - Hoà tan nhanh được một số chất rắn cụ thể (đường, muối ăn, thuốc tím...) trong nước. - Phân biệt được hỗn hợp với dung dịch, chất tan với dung môi, dung dịch bão hoà với dung dịch chưa bão hoà trong một số hiện tượng của đời sống hàng ngày. - Thái độ: Tạo hứng thú cho học sinh yêu thích môn học 2. Phẩm chất, năng lực cần hình thành và phát triển cho học sinh: II. CHUẨN BỊ: GV: Dụng dụ. Hoá chất: - Cốc thủy tinh. - Kiềng sắt + lưới đun. - Đèn cồn. - Đũa thủy tinh. - Đường, muối ăn. - Dầu hoả (xăng). - Dầu ăn. - Nước. HS: Tìm hiểu trước nội dung bài học III. TỔ CHỨC CÁC HOẠT ĐỘNG DẠY HỌC 1. Ổn định lớp: (1 phút) 2. Kiểm tra bài cũ: (không) 3. Nội dung bài mới Hoạt động của giáo viên Hoạt động của HS Nội dung kiến thức HĐ1: Hoạt động tìm hiểu thực tiễn (1 phút) a) Mục đích hoạt động: Dẫn dắt học sinh vào bài dung dịch Nội dung: Tìm hiểu về dung dịch b) Cách thức tổ chức hoạt động: Trong thí nghiệm hóa học hoặc trong đời sống hàng ngày các em thường hòa tan nhiều chất như đường; muối; rượu...trong nước, ta có dung dịch đường; muôi; rượu...Vậy dung dịch là gì tiết học này các em sẽ tìm hiểu. - HS lắng nghe HĐ2: Hoạt động tìm tòi, tiếp nhận kiến thức. Kiến thức 1: (14 phút) a) Mục đích hoạt động: Tìm hiểu khái niệm dung môi, chất tan và dung dịch. Nội dung: Khái niệm dung môi, chất tan và dung dịch. b) Cách thức tổ chức hoạt động: - Giới thiệu qua mục tiêu của chương à bài - Hướng dẫn HS làm thí nghiệm. Thí nghiệm 1: Cho 1 thìa đường vào cốc nước à khuấy nhẹ. Các nhóm quan sát à ghi lại nhận xét à trình bày. - Ở thí nghiệm này. + Đường là chất tan. + Nước hoà tan đường à dung môi. + Nước đường à dung dịch. Thí nghiệm 2: Cho vào mỗi cốc một thìa dầu ăn (cốc 1 đựng nước, cốc 2 đựng dầu hoả ) à khuấy nhẹ. - Thảo luận nhóm và cho biết: chất tan, dung môi ở thí nghiệm 2. - Vậy em hiểu thế nào là dung môi; chất tan và dung dịch? - Hãy lấy ví dụ về dung dịch và chỉ rõ chất tan, dung môi trong dung dịch đó. - Khối lượng của dung dịch được tìm ntn? - Thí nghiệm 1: làm thí nghiệm đường tan vào nước tạo thành nước đường (là dung dịch đồng nhất). - Nêu nhận xét: + Cốc 1: nước không hoà tan được dầu ăn. + Cốc 2: dầu hoả hoà tan được dầu ăn tạo thành hỗn hợp đồng nhất. - Dầu ăn: chất tan. - Dầu hoả: dung môi. - Đọc phần kết luận (sgk) -Ví dụ: Nước biển. + Dung môi: nước. + Chất tan: muối Nước mía. + Dung môi: nước. + Chất tan: đường mdd = mct + mdm I. Dung môi - chất tan - dung dịch Thí nghiệm 1: (sgk) Thí nghiệm 1: (sgk) Kết luận: - Dung môi là chất có khả năng hoà tan chất khác để tạo thành dung dịch. - Chất tan là chất bị hoà tan trong dung môi. - Dung dịch là hỗn hợp đồng nhất của dung môi và chất tan. Kiến thức 2: (10 phút) a) Mục đích hoạt động: Tìm hiểu dung dịch bão hoà và dung dịch chưa bão hoà. Nội dung: Dung dịch bão hoà và dung dịch chưa bão hoà. b) Cách thức tổ chức hoạt động: - Hướng dẫn HS làm thí nghiệm 3. + Tiếp tục cho đường vào cốc ở thí nghiệm 1 à khuấy à nhận xét. - Khi dung dịch vẫn còn có thể hoà tan được thêm chất tan à gọi là dung dịch chưa bão hoà. - Hướng dẫn HS làm tiếp thí nghiệm 3: tiếp tục cho đường vào cốc dung dịch trên, vừa cho đường vừa khuấy. - Dung dịch không thể hòa tan thêm được chất tan à dung dịch bão hoà. - Vậy thế nào là dung dịch bão hoà và dung dịch chưa bão hoà? - Yêu cầu các nhóm trình bày và nhận xét. Làm thí nghiệm 3. - Dung dịch nước đường vẫn có khả năng hoà tan thêm đường. - Dung dịch nước đường không thể hoà tan thêm đường (đường còn dư). - Đọc phần kết luận(sgk) II. Dung dịch chưa bảo hòa và dung dịch bảo hòa Thí nghiệm : (sgk) Kết luận Ở một t0 xác định: - Dung dịch chưa bão hoà là dung dịch có thể hoà tan thêm chất tan. - Dung dịch bão hoà là dung dịch không thể hoà tan thêm chất tan. HĐ 3: (12 phút) a) Mục đích hoạt động: Làm thế nào để quá trình hoà tan chất rắn trong nước. Nội dung: Quá trình hoà tan chất rắn trong nước. b) Cách thức tổ chức hoạt động: - Hướng dẫn HS làm thí nghiệm: cho vào mỗi cốc (25 ml nước) một lượng muối ăn như nhau. + Cốc I: để yên. + Cốc II: khuấy đều. + Cốc III: đun nóng + Cốc IV: nghiền nhỏ. -Yêu cầu các nhóm ghi lại kết quả à trình bày. Þ Vậy muốn quá trình hoà tan chất rắn trong nước được nhanh hơn ta nên thực hiện những biện pháp nào? - Yêu cầu các nhóm đọc SGK à thảo luận. ? Vì sao khi khuấy dung dịch quá trình hoà tan chất rắn nhanh hơn. ? Vì sai khi đun nóng, quá trình hoà tan nhanh hơn. ? Vì sao khi nghiền nhỏ chất rắn à tan nhanh. - GV nhận xét và rút ra kết luận - Làm thí nghiệm: cho vào cốc nước 5g muối ăn. + Cốc I: muối tan chậm. + Cốc II, III: muối tan nhanh hơn cốc I (IV). + Cốc IV: tan nhanh hơn cốc I nhưng chậm hơn cốc II & III. - 3 biện pháp: + Khuấy dung dịch: tạo ra sự tiếp xúc giữa chất rắn và các phân tử nước. + Đun nóng dung dịch: phân tử nước chuyển động nhanh hơn tăng số lần va chạm giữa phân tử nước và chất rắn. + Nghiền nhỏ: tăng diện tích tiếp xúc giữa các phân tử nước và chất rắn. III. Làm thế nào để quá trình hòa tan chất rắn trong nước xảy ra nhanh hơn. Muốn quá trình hoà tan chất rắn xảy ra nhanh hơn, thức ăn thực hiện 1, 2 hoặc cả 3 biện pháp sau: - Khuấy dung dịch. - Đun nóng dung dịch. - Nghiền nhỏ chất rắn. 4. Củng cố: (5 phút) Yêu cầu HS nhắc lại nội dung chính: - Dung dịch là gì? Thế nào là dung dịch bão hoà ,dung dịch chưa bão hoà? - HS làm bài tập 5 sgk/138. 5. Hướng dẫn học sinh tự học, làm bài tập và soạn bài mới ở nhà: (2 phút) - HS về nhà học bài, làm bài tập 1,2,3,4,6 - Tìm hiểu trước bài “ Độ tan của một chất trong nước” IV. RÚT KINH NGHIỆM: GV: HS:. DUYỆT TUẦN 31:
File đính kèm:
 giao_an_hoa_hoc_lop_9_tuan_31_nam_hoc_2018_2019_truong_thcs.doc
giao_an_hoa_hoc_lop_9_tuan_31_nam_hoc_2018_2019_truong_thcs.doc

